Zasady postępowania w diagnostyce dermoskopowejZastosowanie dermoskopii w trakcie konsultacji dermatologicznej wydłuża całkowity czas badania tylko o 72 sekundy, a korzyści z przeprowadzenia tego badania u chorych w stosunku do poświęconego czasu są ogromne w aspekcie profilaktyki czerniaka.
Większość pacjentów zgłasza się do badania dermoskopowego z powodu niepokojących znamion melanocytowych. Badanie dermoskopowe zmian źle wyglądających tzw. brzydkich kaczątek (ugly duckling sign) charakteryzuje się dość wysoką czułością w rozpoznaniu czerniaków. Żelazną zasadą obowiązującą w dermoskopii jest konieczność zbadania wszystkich zmian skórnych. Badanie nie powinno ograniczać się do oceny źle wyglądających zmian (ugly duckling) ze względu na możliwość przeoczenia czerniaka. Obejrzenie wszystkich zmian barwnikowych na ciele umożliwia również ustalenie proflu znamion barwnikowych, uwarunkowanego między innymi fototypem skóry badanego. W wielu przypadkach, jeśli niepokojące cechy występują w większej liczbie znamion melanocytowych, oznacza to, że wybrany typ znamion jest charakterystyczny dla danego pacjenta i nie stanowią one wówczas powodu do niepokoju. Badanie Argenziano i wsp. potwierdza zasadę, że oceny znamion melanocytowych należy dokonywać nie tylko na podstawie cech morfologicznych pojedynczej zmiany, ale należy rozpatrywać jej cechy w kontekście ogólnego wzorca dermoskopowego pozostałych znamion melanocytowych pacjenta.Ocena dermoskopowa wybranej zmiany melanocytowej powinna opierać się o kryteria analizy wzorca zmiany – cech globalnych (uwarunkowanych wybranymi typami wzorców) oraz cech lokalnych (w oparciu o wybrane struktury dermoskopowe), a także w oparciu o algorytmy analizy dermoskopowej.
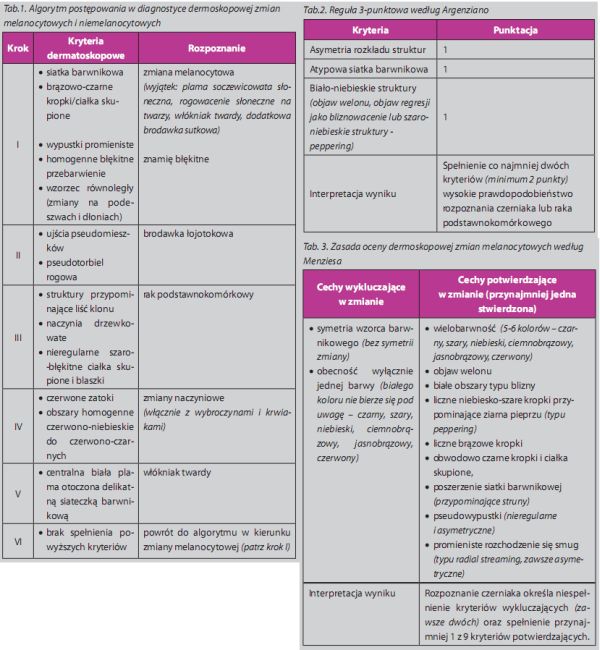
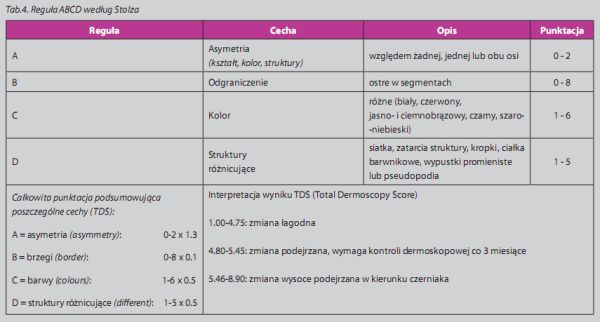
Wzorzec dermoskopowy badanej zmiany barwnikowej zależy od wieku i fototypu badanego, lokalizacji i ekspozycji zmiany na promieniowanie ultrafoletowe, a także ciąży oraz dynamiki wzrostu. Należy pamiętać, aby rutynowo nie oceniać znamion melanocytowych do dwóch miesięcy po zakończeniu ekspozycji na promieniowanie ultrafioletowe. W badaniu dermoskopowym postępujemy według dermoskopowego algorytmu diagnostyki różnicowej, przedstawionego w tabeli 1. Poza analizą wzorca zmian melanocytowych stosujemy algorytmy diagnostyki dermoskopowej, do których zalicza się m.in. regułę 3 – punktową (tab.2), zasadę Menziesa (tab.3), czy też ocenę całkowitego wskaźnika badania dermoskopowego (TDS) wg Stolza (tab.4).
Regularna obserwacja dermoskopowa pacjentów z licznymi zmianami melanocytowymi jest bardzo dobrą strategią pomagającą uniknąć przeoczenie czerniaka, ale także ograniczyć niepotrzebne zabiegi chirurgiczne. Pierwsze kontrolne badanie dermoskopowe powinno być wykonane po 3 miesiącach od pierwszej oceny. Należy pamiętać ponadto o regularnej corocznej kontroli zmian barwnikowych prowadzonej nawet do 3 lat, w celu wykrycia tzw. czerniaków wolnorosnących, które w obrazie dermoskopowym wykazywać mogą niewielkie lub umiarkowane zmiany np. jako powiększenie średnicy powyżej 2 mm, bardzo często bez rozwoju innych kryteriów dermoskopowych charakterystycznych dla zmian złośliwych. Piśmiennictwo
1.Argenziano G., Soyer H.P., Chimenti S., Talamini R., Corona R., Sera F., Binder M., Cerroni L., De Rosa G., Ferrara G., Hofmann-Wellenhof R., Landthaler M., Menzies S.W., Pehamberger H., Piccolo D., Rabinovitz H.S., Schiffner R., Staibano S., Stolz W., Bartenjev I., Blum A., Braun R., Cabo H., Carli P., De Giorgi V., Fleming M.G., Grichnik J.M., Grin C.M., Halpern A.C., Johr R., Katz B., Kenet R.O., Kittler H., Kreusch J., Malvehy J., Mazzocchetti G., Oliviero M., Ozdemir F., Peris K., Perotti R., Perusquia A., Pizzichetta M.A., Puig S., Rao B., Rubegni P., Saida T., Scalvenzi M., Seidenari S., Stanganelli I., Tanaka M., Westerhoff K., Wolf I.H., Braun-Falco O., Kerl H., Nishikawa T., Wolff K., Kopf A.W.: Dermoscopy of pigmented skin lesions: results of a consensus meeting via the Internet. J. Am. Acad. Dermatol., 2003; 48: 679-6932.Argenziano G., Catricalà C., Ardigo M., Buccini P., De Simone P., Eibenschutz L., Ferrari A., Mariani G., Silipo V., Zalaudek I.: Dermoscopy of patients with multiple nevi: Improved management recommendations using a comparative diagnostic approach. Arch Dermatol., 2011; 147:46-493.Argenziano G., Ferrara G., Francione S., Di Nola K., Martino A., Zalaudek I.: Dermoscopy-the ultimate tool for melanoma diagnosis. Semin Cutan Med Surg., 2009; 28:142-1484.Argenziano G., Kittler H., Ferrara G., Rubegni P., Malvehy J., Puig S., Cowell L., Stanganelli I., De Giorgi V., Thomas L., Bahadoran P., Menzies SW., Piccolo D., Marghoob AA., Zalaudek I.: Slow-growing melanoma: a dermoscopy follow-up study. Br J Dermatol., 2010; 162: 267-2735.Argenziano G., Mordente I., Ferrara G., Sgambato A., Annese P., Zalaudek I.: Dermoscopic monitoring of melanocytic skin lesions: clinical outcome and patient compliance vary according to follow-up protocols. Br J Dermatol. 2008; 159: 331-3366.Kamińska-Winciorek G.: Dermatologia cyfrowa. Cornetis, Wrocław, 2008; 11-847.Kamińska-Winciorek G.: Dermatoskopia znamion melanocytowych: wpływ promieniowania ultrafioletowego. Przegl. Dermatol., 2008; 95: 463-4678.Kamińska-Winciorek G., Śpiewak R.: Dermoskopia zmian melanocytowych dla początkujących ( w przygotowaniu do druku)9.Ruka W., Krzakowski M., Placek W., Rutkowski P., Nowecki Z., Fijuth J., Nasierowska-Guttmejer A., Jeziorski A., Rudnicka L., Murawa P., Słuszniak J., Potemski P., Zaucha R., Wysocki P., Kamińska-Winciorek G., Bajcar S., Drosik K., Biernat W., Towpik E.: Czerniaki skóry – zasady postępowania diagnostyczno-terapeutycznego. Przegl Dermatol., 2009; 96: 193–20310.Scope A., Dusza SW., Halpern AC., Rabinovitz H., Braun RP., Zalaudek .I, Argenziano G., Marghoob AA.: The „ugly duckling” sign: agreement between observers. Arch Dermatol., 2008;144: 58-6411.Soyer H.P., Argenziano G., Ruocco V., Chimenti S.: Dermoscopy of pigmented skin lesions. Eur. J. Dermatol. 2001; 11: 270-276 study. Arch Dermatol. 2008 Apr;144(4):509-13.12.Zalaudek I., Argenziano G., Soyer HP., Corona R., Sera F., Blum A., Braun RP., Cabo H., Ferrara G., Kopf AW., Langford D., Menzies SW., Pellacani G., Peris K., Seidenari S.: DERMOSCOPY WORKING GROUP. Three-point checklist of dermoscopy: an open internet study. Br J Dermatol., 2006; 154:431-43713.Zalaudek I., Kittler H., Marghoob AA., Balato A., Blum A., Dalle S., Ferrara G., Fink-Puches R., Giorgio CM., Hofmann-Wellenhof R., Malvehy J., Moscarella E., Puig S., Scalvenzi M., Thomas L., Argenziano G.: Time required for a complete skin examination with and without dermoscopy: a prospective, randomized multicenter study. Arch Dermatol. 2008; 144: 509-51314.Zalaudek I., Manzo M., Savarese I., Docimo G., Ferrara G., Argenziano G.: The morphologic universe of melanocytic nevi.: Semin Cutan Med Surg., 2009; 28:149-15615.Zalaudek I., Argenziano G., Soyer H.P., Corona R., Sera F., Blum A., Braun R.P., Cabo H., Ferrara G., Kopf A.W., Langford D., Menzies S.W., Pellacani G., Peris K., Seidenari S.: The Dermoscopy Working Group: Three-point checklist of dermoscopy: an open internet study. Br. J. Dermatol., 2006; 154: 431-437