Pierwsze opisy oczu zwierząt powstały już w starożytnym Egipcie, a pierwsze opisy patologii oczu sięgają lat 500 n.e. Najwcześniejsze i najwierniejsze opisy anatomii oka końskiego opublikował w XVII wieku, kowala Jej Wysokości – Andrew Snape. Leonardo Da Vinci z kolei, prowadził obserwacje porównawcze martwych oczu ludzkich i zwierząt. Wysnuł teorię, że im większe oko, tym większa źrenica, a co za tym idzie lepsze widzenie w nocy. Jest to przykład dobrej obserwacji z błędnym wnioskiem, co z kolei opisali późniejsi filozofowie.
W okulistyce koni najczęstszymi problemami są: urazy (nierzadko perforujące rogówkę z wypadnięciem tęczówki), immunologiczne zapalenia rogówki, zapalenie błony naczyniowej. Wspomniana choroba powiązała trwale okulistykę ludzką z weterynaryjną, gdy pięćdziesiąt lat temu odkryto podobieństwa w patogenezie. Do dziś modelem do badań nad autoimmunologicznym zapaleniem błony naczyniowej ludzi jest nawracające zapalenie błony naczyniowej koni. Stąd w tym artykule parę słów właśnie o specyfice tego zapalenia u koni. Nawracające zapalenie błony naczyniowej oka (iridocyclitis, periodic ophthalmia, equine recurrent uveitis – ERU) określane jako ślepota miesięczna (moon blindness) jest na całym świecie główną przyczyną ślepoty koni. W Stanach Zjednoczonych choroba ta dotyczy ok. 8% a w Polsce ok. 10% koni. Ślepotę miesięczną charakteryzuje występowanie ostrych rzutów zapaleń wewnątrzgałkowych albo pojawianie się nawracających, ledwo dostrzegalnych stanów zapalnych błony naczyniowej oka. U koni choroba jest podstępna, gdyż nie zawsze właściciel konia jest w stanie zaobserwować objawy natychmiast po ich wystąpieniu. Objawy kliniczne mogą być wówczas zauważone dopiero podczas kolejnego rzutu, po tygodniach lub miesiącach od wystąpienia pierwszego ataku choroby.
Na początku dwudziestego wieku wysunięto hipotezę genetycznego podłoża choroby. Dyskusje o genetycznych predyspozycjach do ERU toczą się od wielu lat. Choroba najczęściej stwierdzana jest u koni Appaloosa, europejskich gorącokrwistych i kilku innych ras. Udowodniono tę hipotezę blisko osiemdziesiąt lat później, wyłącznie u koni rasy Appaloosa. Ostatnio wykazano zdecydowanie częstsze występowanie ERU u koni z MHC i haplotypem ELA-A9. Związek pomiędzy haplotypem MHC (major histocompatibility complex) a podatnością na zapalenie błony naczyniowej opisano wcześniej u ludzi i myszy transgenicznych.
Historyczne doniesienia mówią, że ERU występowało częściej u koni hodowanych na terenach wilgotnych. Podejrzewano również, że chorobę mogą wywoływać wirusy, ale nie zostało to udowodnione. Wielu autorów uważa, że najczęstszą przyczyną choroby są zakażenia Leptospira spp. Należy podkreślić, że większość przypadków była rozpoznawana w stanie przewlekłym, co nie pozwalało na poznanie pierwotnej przyczyny. Badania grupy koni gorącokrwistych potwierdziły jednak podejrzenie, że u niektórych ERU ma podłoże genetyczne i immunologiczne. W gałkach ocznych koni przewlekle chorych stwierdzono naciek komórek jednojądrzastych, składający się przede wszystkim z limfocytów T (CD4+). Ustalono, że nawracanie choroby wynika z nadwrażliwości typu późnego. Czynnik inicjujący jest również przyczyną dla reaktywowania odpowiedzi zapalnej. Wykazano, że pierwszy atak jest często wywołany zakażeniem Leptospira spp., a nawracające ataki ERU mogą być odpowiedzią na różne zakażenia, szczepienia czy stres.
Przyjmuje się, że choroba ma podłoże autoimmunologiczne, ale nie jest znana jej pierwotna przyczyna oraz czynniki wywołujące nawroty. Pierwszym, który zasugerował, że zakażenie Leptospira spp. może brać udział w etiopatogenezie ERU był Heusser w 1948 roku. Twierdził on jednocześnie, że nawroty choroby mają charakter autoagresji, co 55 lat później potwierdził Gerhards.
Przez ostatnią dekadę wiedza na temat odpowiedzi immunologicznej w ERU zdecydowanie się poszerzyła. ERU jest chorobą najczęściej prowadząca do ślepoty u koni. Obraz kliniczny charakteryzuje nawracanie wewnątrzgałkowego zapalenia, a leczenie opiera się na stosowaniu leków przeciwzapalnych. Przez wiele lat sądzono, że przyczyną nawrotów ERU jest rozregulowanie odpowiedzi immunologicznej. Badania ostatnich lat wykazały, że komórkami najliczniej naciekającymi błonę naczyniową gałki ocznej w tym zapaleniu są komórki T. Odpowiedź autoimmunologiczna jest skierowana przeciwko autoantygenom siatkówki takim jak np. antygen S (S-Ag), czy międzyreceptorowe białko wiążące retinoid (interfotoreceptor retinoid binding protein- IRBP) . Możliwe jest wywołanie eksperymentalnego ERU poprzez obwodowe podanie tych białek w formie zemulgowanej, zawieszonych w kompletnym adiuwancie Freunda (CFA). Nie u wszystkich koni udaje się jednak w ten sposób wywołać chorobę. Ostatnio odkryto dwa kolejne autoantygeny: rekowerynę oraz białko wiążące aldehyd retinowy (CRALB), co pomogło zrozumieć kolejne aspekty autoimmunologicznego zapalenia błony naczyniowej oka u ludzi.
Fakt, że chore konie dobrze reagują na leczenie przeciwzapalne glikokortykosteroidami oraz cyklosporyną w formie implantu podtwardówkowego oraz równoczesny brak pozytywnej reakcji na leczenie miejscowe antybiotykami przekonują, że ERU jest chorobą o podłożu immunologicznym.
Hipotezę tę wspierają badania, w których wykazano obecność w nacieku zapalnym komórek T, z przewagą CD4+, o fenotypie Th1. Nacieki stwierdzono w tęczówce i siatkówce. W zrębie tęczówki tworzą one i formują charakterystyczne, podobne do pęcherzyków, struktury zawierające komórki T. Kolejne badania ujawniły, że pochodzące z nich limfocyty T proliferują in vitro po stymulacji IRBP lub S-Ag. Oba białka występują wyłącznie w siatkówce i szyszynce. Opisano je po raz pierwszy u gryzoni z doświadczalnie wywołanym zapaleniem błony naczyniowej oka. Eksperymentalnie wywołane zapalenie błony naczyniowej oka u świnek morskich, przez podanie roztworu białek siatkówki, doprowadziło do zaangażowania w proces zapalny szyszynki. W gruczole tym stwierdzono naciek limfocytarny, zanim podobne zmiany pojawiały się w siatkówkach. Interesujące jest, że ta sama grupa badaczy potwierdziła zapalenie szyszynki u pacjentów z ERU, pomimo przekonania, że to leptospiry mają decydujący udział w etiologii. Okolice przegród szyszynki u koni z ERU nacieczone były przez komórki prezentujące antygen, na których oznaczono cząsteczki białek MHC klasy II oraz limfocyty T.
Ekspresja chemokin takich jak RANTES (regulated upon activation, normal T cell expressed and secreted) może odgrywać rolę w aktywacji leukocytów w nabłonku rzęskowym oczu koni chorych na ERU. Związek choroby z reakcją zapalną potwierdzają dobre efekty terapii o charakterze immunosupresyjnym, od wielu lat stosowane w kontrolowaniu przebiegu ERU. Stosowanie glikokortykosteroidów jest działaniem o szerokim spektrum. Bardziej precyzyjną terapią, skierowaną bezpośrednio w komórki T, jest wszczepianie implantu z wolno uwalniającą się cyklosporyną.
Powstawanie i utrzymywanie się reakcji autoimmunologicznej w przebiegu ERU tłumaczy się trzema zjawiskami: mimikrą molekularną, aktywacją komórek sąsiadujących oraz szerzeniem się epitopów. Te mechanizmy nie wykluczają się, przeciwnie, mogą występować niezależnie a nawet współdziałać w rozwoju choroby. W patogenezie większości chorób autoimmunologicznych odpowiedź immunologiczna skierowana jest przeciwko wielu autoantygenom a szerzenie się epitopów przyczynia się do indukcji, progresji i nawrotów zapaleń. Zastosowanie metody 2DE Western blot, z użyciem proteomu siatkówki jako źródła autoantygenów pozwoliło wytypować dwa nowe, poza IRBP i S-Ag, autoantygeny potencjalnie wywołujące ERU. Metoda spektrometrii masowej pozwoliła jednoznacznie zidentyfikować te dwa nowe autoantygeny jako MDH (dehydrogenazę jabłczanową -MDH) oraz CRALBP. Wykazano, że możliwe jest wywołanie ERU poprzez eksperymentalne podanie zwierzętom doświadczalnym tych autoantygenów. MDH i CRALBP podane szczurom szczepu Lewisa wywołały zapalenie błony naczyniowej u ponad 70% zwierząt. Struktura siatkówki została znacznie zniszczona włącznie z całkowitą utratą fotoreceptorów i zmianami w poszczególnych warstwach. Deeg i Hauck w 2006 roku podali oba autoantygeny koniom. Wyniki były zaskakujące, gdyż iniekcje nie wywołały ERU. Tak więc wyniki eksperymentu przeprowadzonego na gryzoniach nie mogą być bezpośrednio odnoszone do innych gatunków. Podobne doświadczenie wykazało, że podawanie szczurom S-Ag, uważanego za główny autoantygen w przebiegu zapalenia błony naczyniowej oka, nie stanowi wystarczającego dobrego modelu do badań. Powodem jest fakt, że S-Ag wywołuje zapalenie błony naczyniowej u gryzoni, ale jednofazowe. U koni po podaniu S-Ag wykryto wyższe miana auto przeciwciał S-Ag oraz autoreaktywne komórki T reagujące in vitro z S-Ag i pochodnymi białkami. Niemniej jednak w większości przypadków doświadczalnych, komórki T nie przekroczyły bariery krew-siatkówka. Podobne działanie miało MDH, które podane koniom pobudziło reakcję immunologiczną , ale nie wywołało zapalenia błony naczyniowej oka.
Potwierdzono natomiast rolę autoantygenu CRALBP, który nie tylko wywołuje ERU, ale również indukuje nawroty choroby.
Chociaż udowodniono, że to jednak autoantygeny siatkówki, limfocyty Th1 powodują rozwój choroby oraz jej nawracanie, procesy molekularne prowadzące do zwyrodnienia siatkówki, a w konsekwencji do ślepoty, nie zostały dotychczas poznane. Systematyczna analiza wewnątrzgałkowych proteomów w przebiegu spontanicznego zapalenia błony naczyniowej oka ludzi, jak również u zdrowych koni, pozwoliła na zidentyfikowanie wielu różnych białek regulatorowych, które biorą udział w odpowiedzi immunologicznej i utrzymywaniu bariery krew-siatkówka. Rozważa się rolę pobudzania w siatkówce układu dopełniacza. Wykazano, że duże ilości produktów rozpadu komponentu C3 gromadzone są w przebiegu retinopatii cukrzycowej. Co więcej, u szczurów, u których doświadczalnie wywołano zapalenie błony naczyniowej oka istotne znaczenie miała aktywacja wewnątrzgałkowego receptora komponenty C3 dopełniacza. W trakcie analizy proteomu ciała szklistego i siatkówki w przebiegu ERU zauważono także osłabioną ekspresję białek związanych z utrzymywaniem bariery krew-siatkówka. Innym białkiem, które może odgrywać rolę w rozwoju ERU, jest czynnik pochodzący z nabłonka pigmentowanego siatkówki (PEDF – pigment epithelium derived factor). Ma on działanie neurotroficzne oraz silnie hamuje angiogenezę . Czynnik ten produkowany jest przez komórki pigmentowanego nabłonka siatkówki – RPE (retinal pigment epithelium) jak również przez komórki zwojowe Muellera. Ekspresja PEDF podczas zapalenia jest obniżana do 20% w stosunku do prawidłowej. Jego funkcją jest regulacja zapalenia i hamowanie przepuszczalności śródbłonka. W przebiegu ERU ekspresja PEDF w siatkówce zmniejsza się z jednoczesnym pojawieniem się VEGF (VEGF- vascular endothelial growth factor) oraz interferonu gamma (INF-γ). Dodatkowo zmianom tym towarzyszy zwiększona ekspresja wimentyny i zmniejszona aktywność syntetazy glutaminowej (glutamine synthetase). Zmiany w ekspresji i aktywności tych czynników wskazują na aktywację komórek Muellera, które zamiast obniżać ekspresję PEDF, wytwarzają INF-γ, prozapalną cytokinę typową dla odpowiedzi Th1. W ten sposób komórki Muellera mogą przyczyniać się do postępu choroby.
Nawroty ERU mogą występować nawet u koni, u których doszło do całkowitej utraty wzroku i/lub postępuje zanik gałek ocznych. Wiadomo obecnie, że ekspresja CRALBP, IRBP i S-Ag nie zmienia się w gałkach ocznych, nawet w stanie zaniku. Tak więc białka te mogą stale przyczyniać się do nawrotów choroby.
Hipoteza zainicjowania odpowiedzi autoimmunologicznej przez czynnik zakaźny jest znana od dziesięcioleci. Tłumaczona jest mimikrą antygenową, co oznacza, że odpowiedź immunologiczną pobudza czynnik zakaźny i przeciwko niemu jest ona skierowana. Jednocześnie jednak pojawia się reakcja krzyżowa z podobnymi epitopami własnych tkanek i dochodzi do ich uszkodzenia. Chociaż w oczach koni z ERU stwierdza się intensywną odpowiedź przeciwko antygenom Leptospir, pozostaje niejasnym czy jest ona pobudzana w oku czy jest skutkiem przerwania bariery krew- siatkówka. Stosunek Ig G do albumin w chorych oczach sugeruje raczej przesięk białek przez uszkodzoną barierę krew – płyny gałki ocznej, niż wewnątrzgałkową syntezę przeciwciał.
Nadal ścierają się hipotezy czy w etiologii ERU odpowiedź autoimmunologiczna ma charakter spontaniczny, czy też jest reakcją na czynnik zakaźny. Ostatnie pięć lat, to czas dynamicznego rozwoju badań potwierdzających udział leptospir w etiopatogenezie ERU.
Związek obecności leptospir z uszkodzeniem struktur gałek ocznych koni z ERU opisywano już w 1992 i 2002 roku. Jednak dopiero niedawno wykryto, o jaką reakcję chodzi. Lipoproteiny leptospir Lru A i Lru B okazały się antygenami pobudzającymi wytwarzanie przeciwciał reagujących krzyżowo ze strukturami oka. Stwierdzono, że przeciwciała przeciwko Lru A reagują z białkami soczewki α-krystaliną B i wimentyną, natomiast przeciwciał przeciwko LruB z białkiem siatkówki β-krystaliną B2. Ponadto udział leptospir w patogenezie ERU potwierdza izolacja tych bakterii z płynów gałek ocznych chorych koni.
Objawy ERU pojawiają się często dopiero po miesiącach, a nawet po latach od naturalnego lub doświadczalnego zakażenia leptospirami. U patogennych leptospir w odpowiedzi na zmianę warunków (temperatury, osmolarności) zwiększa się ekspresja wielu białek.
Gałka oczna wypełniona roztworem albumin, chlorków, wodorowęglanów, obojętnych aminokwasów i niewielkich ilości nierozpuszczalnych proteoglikanów, stanowi środowisko ubogie w składniki odżywcze, co zmusza leptospiry do adaptacji.
Opracowanie efektywnego schematu leczenia ERU wymaga poznania sposobu przetrwania leptospir w gałce ocznej i sposobu w jaki inicjują one zmiany patologiczne. Pomimo dowodu na związek zakażenia leptospirami z wystąpieniem ERU, patogeneza choroby jest słabo poznana, głównie z powodu braku wystarczającej wiedzy o antygenowości protein tych drobnoustrojów. Dopiero w 2005 roku opisano LruA i LruB jako białka leptospir istotne w rozwoju zapalenia błony naczyniowej gałki ocznej. Metodą Southern blotting potwierdzono obecność LruA i LruB u wielu patogennych i saprofitycznych leptospir. LruA oznaczono u L. interrogans w serogroupie icterohemorrhagiae, serowar copenhageni oraz serowary pomona (pomona i JEN4), canicola, hardjo, bratislava, grippotyphosa, nie oznaczono u: L. biflexa, L. inadai ani Leptonema illini. LruB potwierdzono również u serowarów L. interrogans, ale nie stwierdzono u saprofitycznej L. biflexa, L. inadai, ani niepatogennej L. weilii. Wydaje się, że LruA and LruB są typowe wyłącznie dla patogennych gatunków leptospir, tym bardziej, że nie występują u gatunków saprofitycznych (L. biflexa). Wydaje się, że LruB występuje wyłącznie u L. interrogans. Badania pod kierownictwem Vermy po raz pierwszy ujawniły proteiny leptospir, które pobudzają wytwarzanie przeciwciał reagujących krzyżowo z tkankami w gałce ocznej koni z ERU. Z badań tych wynika, że lokalna humoralna odpowiedź immunologiczna skierowana jest przeciwko wielu proteinom leptospir. Większość z nich pobudza odpowiedź immunologiczną również w zakażeniach wywołujących poronienia. LruA and LruB są jednak wyjątkowo istotne, gdyż wywołują silną odpowiedź IgG oraz IgA w oczach z zapaleniem błony naczyniowej.
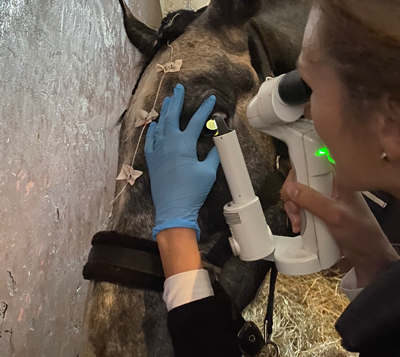
Celem postępowania leczniczego jest zachowanie widzenia, zmniejszenie bolesności oraz zapobieżenie lub zminimalizowanie ryzyka nawrotowych ataków zapalenia błony naczyniowej. Leczenie powinno być prowadzone intensywnie. Terapia może trwać tygodniami a nawet miesiącami i nie należy jej nagle przerywać. Do niedawna ślepotę miesięczną leczono wyłącznie metodą zachowawczą. W 1989 roku Werry i Gerhards wprowadzili leczenie operacyjne. Leczenie zachowawcze polega na leczeniu objawowym. Miejscowo, do worka spojówkowego zwykle przez wszytą kaniulę podpowiekową, podawane są: mydriatyki, kortykosteroidy, chemioterapeutyki, leki niesterydowe przeciwzapalne. Jednocześnie ogólnie podawane są niesterydowe leki przeciwzapalne i czasami antybiotyki. Obecnie stosowane są u koni dwie metody leczenia chirurgicznego: witrektomia oraz wszczepianie implantu cyklosporyny A. Większość koni ze ślepotą miesięczną, leczonych zachowawczo, z przynajmniej dwunawrotową historią choroby, spełnia kryteria i może być poddana leczeniu operacyjnemu. Zabieg jest wskazany u koni, u których mimo troskliwej opieki i regularnego stosowania leków nadal występują nawroty zapalenia. Witrektomii unika się u pacjentów z ostrymi objawami choroby, z owrzodzeniem rogówki, rozległymi zrostami tylnymi, dojrzałą zaćmą, odwarstwieniem siatkówki. Złe rokowanie dotyczy koni, u których stwierdzono jaskrę (ciśnienie wewnątrzgałkowe powyżej 50 mm Hg, górna granica normy to 25mmHg) lub odwarstwienie bądź odklejenie siatkówki. Prof. Gerhards wykonywał operację witrektomii u koni, u których obecne były zrosty tylne, trwał stan zapalny, czy też stwierdzano początek zaćmy. Operacje te miały jednak na celu wyłącznie podniesienie komfortu koni i zapobieżenie kolejnym nawrotom choroby. Celem zabiegów nie było polepszenie widzenia.
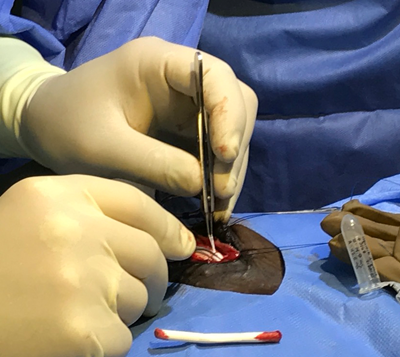
W Polsce z dużym powodzeniem przeprowadza się zabieg wszczepiania implantu podtwardówkowego z cyklosporyną A.
W operacji tej wykorzystywane jest silne immunosupresyjne działanie cyklosporyny. Implant uwalnia się w ilości 4 mikrogramów dziennie. Całkowity czas uwalniania się leku z implantu szacuje się na 5 lat. Wykonanie wszczepienia implantu wskazane jest u pacjentów, u których kolejne nawroty zapalenia błony naczyniowej są coraz częstsze, a ich przebieg jest ostry. Należy zwrócić uwagę, że właściciele młodych koni sportowych, niechętnie zgadzają się na przerwanie treningu i podjęcie długotrwałego leczenia, dlatego implant jest doskonałym rozwiązaniem. Ponadto nie jest uznany za środek dopingowy, co pozwala koniom i ich właścicielom wygrywać najwyższe nagrody.